(1) Кафедра дерматовенерологии Лечебного факультета ФГБОУВО “Российский национальный исследовательский медицинский университет им. Н.И. Пирогова ” МЗ РФ, Москва
(2) ООО “Компания Реднор”, Москва
(3) Деканат Лечебного факультета ФГБОУ ВО “Российский национальный исследовательский медицинский университет им. Н.И. Пирогова” МЗ РФ, Москва
Представлен клинический случай формирования гипертрофического рубца после хирургического удаления папилломатозного невуса на коже спины. Через 3 нед после операции на осмотре отмечено начало формирования гипертрофического рубца и принято решение о профилактическом курсе IPL-терапии. Пациенту был назначен курс из 3 процедур с интервалом 3 нед. После курса IPL-терапии получен стойкий удовлетворительный косметический результат. Мы считаем обязательным назначать повторный осмотр пациентам, которым было произведено хирургическое удаление глубоких доброкачественных образований кожи, через 3 нед от момента операции. Именно в этот период возможна минимизация косметического дефекта с помощью IPL-терапии.
Ключевые слова: папилломатозный невус, доброкачественное образование кожи, гипертрофический рубец, IPL-терапия
Рубец — это физиологический ответ на повреждение кожного покрова и слизистых оболочек [1]. В настоящее время единой классификации рубцов не существует. Разные авторы классифицируют рубцы по давности существования, конфигурации, локализации, отношению к подлежащим тканям, размерам [1, 2]. Принято разделять рубцы на нормотрофические, атрофические, гипертрофические и келоидные [1]. Официальные данные по заболеваемости и лице, открытых участках тела, половых органах рубцы могут оказывать негативное влияние на психику пациента, снижать самооценку и вызывать чувство психосоциальной изоляции [2].
Дерматологи работают с пациентами, которым бывает необходимо удалить различные доброкачественные образования кожи, залегающие глубже базальной мембраны, что неизбежно приводит к формированию рубцовой ткани. Как правило, это небольшие гипертрофические рубцы (до 1—2 см), которые тем не менее вызывают у пациентов сильный дискомфорт [2]. Важно учитывать все факторы, влияющие на формирование рубца: локализацию в определенных анатомических областях, наследственную предрасположенность, IV—VI фототип кожи. При правильном понимании процесса заживления раны возможно профилактически влиять на формирование рубцовой ткани и снижать риск образования гипертрофических рубцов. Заживление раны с формированием рубца включает в себя 3 фазы: воспаления, пролиферации и ремоделирования.
Фаза воспаления. Длительность фазы составляет 48—72 ч от момента повреждения. При травме в поврежденной ткани образуется фибриновый сгусток, который обеспечивает гемостаз и индуцирует сложный воспалительный ответ [2, 3]. Тучные клетки, расположенные в большом количестве по краям сосудов, и активированные тромбоциты выделяют химические медиаторы, которые способствуют вазодилатации и повышению проницаемости сосудов. Это увеличивает местный кровоток и облегчает миграцию клеток воспаления [3]. Нейтро- филы являются первыми клетками, мигрирующими в матрицу фибринового сгустка. Они фагоцитируют клеточные частицы, бактерии и инородные вещества, а также выделяют ряд факторов (интерлейкин-1, интерлейкин-6, фактор некроза опухолей а), способствующих развитию воспалительной реакции [4]. Число нейтрофилов возрастает в течение 24—48 ч, после чего их количество снижается и доминирующими клетками в ране способствуют взаимодействия между белками-интегринами на поверхности клеток и такими компонентами внеклеточного матрикса, как фибрин, витронектин, фибронектин и гиалуроновая кислота [3]. При нормальном заживлении ран происходит апоптоз фибробластов, после того как они сформируют внеклеточный матрикс [6].
Важным процессом в синтезе грануляционной ткани является ангиогенез. Начиная со 2-го дня после травмы эндотелиальные клетки в местных неповрежденных капиллярах временно разрушают их базальную мембрану, мигрируют в рану и образуют новые капилляры [7]. Матричные металлопротеиназы играют решающую роль в ангиогенезе, четко становятся моноциты. Моноциты притягиваются к ране фрагментами белка внеклеточного матрикса, трансформирующим фактором роста в, моноцитарным хемоаттрактантным белком-1 и превращаются в макрофаги [4]. Макрофаги осуществляют дальнейший фагоцитоз мертвых клеток и способствуют образованию грануляционной ткани [4]. В фазе воспаления также участвуют Т-лимфоциты, фиброциты и эозинофилы. Воспалительная фаза заживления ран служит главным образом для подготовки раневой среды к восстановлению. Примерно через 72 ч после травмы воспалительная фаза переходит в пролиферативную [4].
Фаза пролиферации.Длительность фазы составляет от 72 ч до 6 нед. Примерно через 3 сут после травмы раневой дефект начинает заполняться грануляционной тканью [5]. В пролиферативной фазе фибробласты являются основным клеточным агентом. Их функция заключается в образовании коллагена для обеспечения структурной целостности новой ткани и рубца. Фибробласты перемещаются вдоль волокон соединительной ткани в ране, чему способствуют взаимодействия между белками-интегринами на поверхности клеток и такими компонентами внеклеточного матрикса, как фибрин, витронектин, фибронектин и гиалуроновая кислота [3]. При нормальном заживлении ран происходит апоптоз фибробластов, после того как они сформируют внеклеточный матрикс [6].
Важным процессом в синтезе грануляционной ткани является ангиогенез. Начиная со 2-го дня после травмы эндотелиальные клетки в местных неповрежденных капиллярах временно разрушают их базальную мембрану, мигрируют в рану и образуют новые капилляры [7]. Матричные металлопротеиназы играют решающую роль в ангиогенезе, четко направляя миграцию эндотелиальных клеток через внеклеточный матрикс. Фибриллы белка внеклеточного матрикса образуют каркас, на который перемещаются мигрирующие эндотелиальные клетки [6]. Концентрация кровеносных сосудов в грануляционной ткани может быть в 3 раза выше, чем в нормальной ткани, этим объясняется интенсивный красный цвет рубца. Позднее многие капилляры редуцируются через апоптоз эндотелиальных клеток [8].
Процесс эпителизации раны начинается через несколько часов после травмы и продолжается в воспалительную и пролиферативную фазы. Через 2—3 нед после травмы дефект замещается грануляционной тканью и покрывается новыми эпителиальными клетками. Раневая ткань состоит из относительно бесклеточной массы дезорганизованного коллагена и других белков внеклеточного матрикса, которые не содержат таких дермальных придатков, как волосяные фолликулы или потовые железы, и покрыта эпителием. Происходит апоптоз фибробластов, макрофагов и эндотелиальных клеток, которые вошли в раневое пространство [5]. На этом этапе начинается фаза ремоделирования.
Фаза ремоделирования.Длительность фазы составляет от 6 нед до 1 года и более от момента повреждения. В фазу ремоделирования коллаген III типа и протеогликаны замещаются коллагеном I типа, ориентация коллагеновых фибрилл становится более организованной [9]. Со временем перегруппировка волокон коллагена приводит к уплощению и размягчению рубца, гиперемия снижается за счет регресса большинства из первоначально сформированных капилляров [6].
Патологическое изменение метаболизма внеклеточного матрикса во вновь синтезированной соединительной ткани может приводить к образованию гипертрофических рубцов [1]. Основную роль в нарушении метаболизма внеклеточного матрикса играют гиперпродукция и повышенная экспрессия фибробластами коллагена I и III типов, а также избыточная неоваскуляризация [1]. Для профилактики формирования гипертрофических рубцов можно воздействовать на заживление раны в фазы пролиферации и ремоделирования. Рубец считается зрелым через 1 год от момента повреждения, и для его коррекции используются различные деструктивные методики.
Существует множество подходов к лечению гипертрофических рубцов: внутри - очаговое введение глюкокортикостероидов, криохирургия, шлифовка СО2-лазером, воздействие пульсирующим лазером на красителях, хирургическое иссечение, лучевое воздействие [1]. Лазерные технологии применяют в разные фазы формирования рубца [10]. Хороший клинический результат получен при работе PDL-лазером (PDL — pulsed dye laser — пульсирующий лазер на красителе) с длиной волны 585 нм [11]. Он действует за счет восстановления экспрессии трансформирующего фактора роста beta, термолиза мелких сосудов и перегруппировки коллагеновых волокон [11].Эффективность такого лазера доказана при лечении гипертрофических рубцов в фазу пролиферации [12]. IPL-терапия (IPL — intensive pulsed light — интенсивный пульсирующий свет) с длиной волны 560 нм также может использоваться в фазы пролиферации и ремоделирования, так как вызывает термолиз патологически измененных сосудов [13]. Фракционные лазеры 1,064 нм Nd:YAG и 1,550 нм Er:YAG продемонстрировали высокую эффективность в улучшении внешнего вида зрелых гипертрофических рубцов [15].
Представляем клиническое наблюдение лечения интенсивным световым излучением пациента с гипертрофическим рубцом после удаления доброкачественного образования кожи.
Клиническое наблюдение
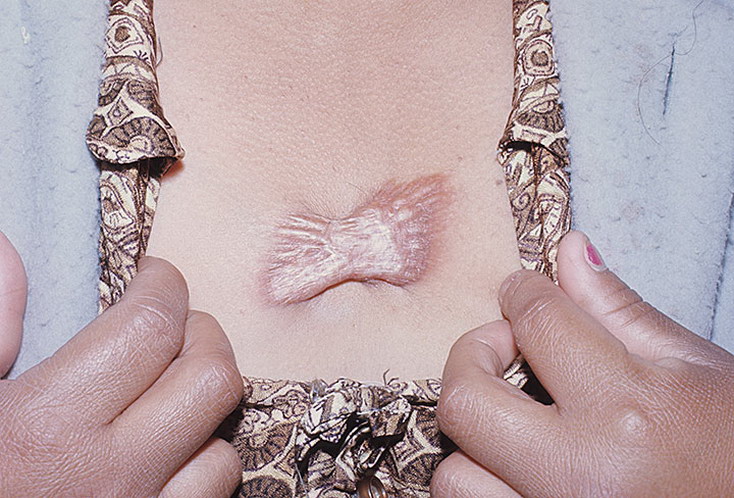
Пациент Н.20 лет, обратился в клинику “Реднор” к дерматологу с жалобами на образование, расположенное на коже поясницы, периодически травмируемое при ношении тесной одежды или ремня. Образование появилось в детском возрасте и постепенно увеличивалось в размерах в последние 5 лет (рис. 1). Пациент настаивал на удалении образования. В возрасте 5 лет обращался к дерматологу с целью удаления папилломатозного невуса на коже груди. Через 1 год после иссечения хирургом по месту жительства у пациента сформировался грубый гипертрофический рубец на месте удаленного невуса.
При осмотре кожные покровы туловища, верхних и нижних конечностей нормальной окраски, свободны от высыпаний;II фототип кожи по Фитцпатрику. На коже в области поясницы округлый узел размером 0,9 х 0,9 см, выступающий над уровнем кожи на 0,6 см, темно-коричневого цвета. Поверхность образования шероховатая, с папилломатозными выростами и вкраплениями темно-коричневого цвета. При пальпации образование мягкое, безболезненное. Дерматоскопия: равномерная пигментная сетка, равномерные гранулы, роговые пробки, милиумподобные кисты. Клинический диагноз: D22.5 меланоформный невус туловища, папилломатозный невус.

Рис.1
Папилломатозный невус на коже поясницы.

Рис.2
Меланоцитарный папилломатозный интрадермальный невус. Окраска гематоксилином и эозином. ×200.
Учитывая размер образования до 1 см, принято решение о скальпируемом хирургическом удалении с последующим гистологическим исследованием и обработкой раневой поверхности СО2-лазером.
Ход операции: под местной инфильтрационной анестезией 2% раствором лидокаина пациенту было выполнено удаление образования. Работа проводилась в два этапа. Первый этап удаления: отсечение скальпелем образования с отступом на участок неизмененной ткани с целью взятия материала для гистологического исследования.Второй этап: обработка раневой поверхности СО2-лазером с целью выравнивания краев раны и остановки кровотечения. Обработка раневой поверхности проводилась в режиме прерывистого излучения с частотой 100 Гц, длительностью импульса 4 мс и мощностью 0,9 Вт с целью минимизации перегрева подлежащих тканей.
Гистологическое исследование: фрагмент кожи, покрытый многослойным плоским ороговевающим эпителием с выраженным папилломатозом. В дерме определяются множественные невусные клетки, расположенные гнездно и россыпью, отделенные от эпидермиса узкими прослойками соединительной ткани. Наблюдается пролиферация мономорфных невусных клеток в дерме.Гистологическое заключение: меланоцитарный папилломатозный интрадермальный невус (рис. 2). Исследование проводилось в CMD (Центр молекулярной диагностики).
При осмотре через 3 нед на месте удаления сформировался узел куполообразной формы, размером 0,9 × 0,9 см, с гладкой блестящей поверхностью. Узел имеет красноватую окраску, по краям гиперпигментация. Границы узла не выходят за границы первоначальной раны и сохраняют ее форму. Субъективно пациента беспокоят зуд и ощущение дискомфорта (рис. 3). Диагноз:L91.0 гипертрофический рубец.

Рис.3
Фаза пролиферации раны:выраженная гиперемия, венчик гиперпигментации по краям рубца.
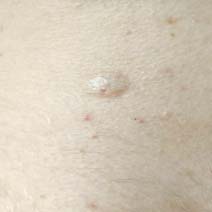
Рис.4
Рубец через 6 мес после удаления невуса.
Учитывая выраженные сосудистые изменения в рубце, для коррекции был выбран метод терапии некогерентным интенсивным световым излучением с длиной волны 560 нм по схеме, представленной в таблице.

Проведена однократная обработка свежего рубца некогерентным интенсивным световым излучением с длиной волны 560 нм. Параметры излучения: длительность 1-го импульса 2 мс, длительность 2-го импульса 4 мс, задержка между импульсами 15 мс, плотность энергии 26 Дж/см2.Повторный осмотр назначен через 3 нед.
При осмотре через 6 нед гипертрофический рубец на месте удаления образования стал более плоским и бледным. Гиперпигментация по краям посветлела. Границы рубца не изменились. Субъективных ощущений нет. Динамика значимого клинического улучшения. Было принято решение продолжить терапию по ранее выбранной схеме.
После проведения намеченного курса терапии из трех процедур рубец стал плоским и не отличался по цвету от окружающих тканей. Гиперпигментация по краям рубца полностью исчезла. Границы рубца не изменились. Субъективные ощущения полностью отсутствовали. Достигнуто значимое клиническое улучшение.
После проведенной терапии пациент находился под наблюдением в течение 2 лет, визиты каждые 6 мес (рис. 4). Спустя 24 мес наблюдался стойкий положительный клинический эффект.
Обсуждение
Мы представили клинический случай с проведением фототерапии гипертрофического рубца интенсивным пульсирующим светом с длиной волны 560 нм у пациента после удаления доброкачественного образования кожи, в результате которой было достигнуто значительное клиническое улучшение.
В 1997 г. IPL-система впервые была применена для лечения доброкачественных сосудистых образований кожи [15]. Учитывая избыточную неоваскуляризацию в фазы пролиферации и ремоделирования раны, использование этого метода для профилактики образования гипертрофических рубцов можно считать патогенетически обоснованным. Нам удалось добиться фототермолиза патологически измененных сосудов в гипертрофическом рубце, что привело к значительному клиническому улучшению и регрессу рубцовой ткани. Профилактический курс обработки рубцов при помощи IPL-систем следует проводить с использованием низких или средних параметров плотности энергии импульса в зависимости от фототипа кожи.
Заключение
Представленную схему терапии мы использовали для профилактики образования гипертрофических рубцов более чем у 200 пациентов, которым было произведено хирургическое или СО2-лазерное удаление глубоких доброкачественных образований кожи диаметром до 2 см в сети медицинских центров “Реднор” с 2002 г. по настоящее время. Во всех случаях у пациентов сформировались нормотрофические рубцы, которые не доставляли беспокойства и не вызывали эстетического дискомфорта. С целью профилактики образования гипертрофических рубцов использовались стандартные параметры излучения: длительность 1-го импульса 2 мс, длительность 2-го импульса 4 мс, задержка между импульсами 15 мс. Плотность энергии импульса варьировала в среднем диапазоне значений и корректировалась в зависимости от фототипа кожи пациента. Фототерапия интенсивным пульсирующим светом с длиной волны 560 нм является перспективным методом профилактики образования и коррекции гипертрофических рубцов.
Конфликт интересов. Авторы заявляют,что данная работа, ее тема, предмет и содержание не затрагивают конкурирующих интересов.
Со списком литературы вы можете ознакомиться на сайте www.atmosphere-ph.ru